现如今,催化反应机理研究是高水平论文必不可少的组成部分。大家已经不仅仅满足于简单的“构效关系”,还希望把连接“构”和“效”之间的黑盒子打开,理解导致这种“构效关系”的内在机制,也就是所谓的反应机理。近十年来,原位漫反射红外光谱、原位拉曼光谱、近常压X射线光电子能谱、原位X射线衍射谱、原位X射线吸收谱、原位穆斯堡尔谱、原位电镜等原位表征技术得到了极大的发展,也越来越频繁得出现在期刊论文上。研究人员无比青睐这种“所见即所得”的实验研究技术。只要建立起完整的标准数据库,无论是作者还是读者都很方便、直观得得到结论。现在的各种技术在压力、温度、传质、传热上无法完全复现真实的催化反应过程,导致很可能出现原位表征数据与实验结论大相径庭。此外,现在的研究者对机理的研究越来越多得依赖于原位表征这种“直接”“暴力”的手段。原位表征也逐渐成为了科研的研究“范式”。然而,早期科学家那种让人“眼前一亮”的实验设计却越来越少。本文将列举从早期到如今的经典文献,学习一下科学家们巧妙的实验设计思路,希望对读者未来的催化机理研究有所启发。
(一)费托合成反应机理研究
费托合成(FTS)反应机理多种多样,最为广泛接受的是如下三种机理(表1)。这三种机理是按照聚合的单体以及链起始物种进行的分类。如何验证某个反应体系属于哪一种机理呢?从原位表征的角度来看,最简单的方式就说通过原位手段探测到亚甲基(CH2)、羟基卡宾(CHOH)和非解离吸附的CO,从而判断反应路径。但在没有这些表征手段的过去,科学家们却通过巧妙的实验验证了这些机理。
Robert C. Brady III和R. Pettit教授通过CH2N2实验证明了FTS走的是碳化物机理[1,2]。CH2N2是用来提供亚甲基单体。(1)当他们通CH2N2和N2的混气时,主产物是乙烯,并没有得到FTS产物分布。这说明单独的CH2*无法碳链增长,只能双聚,证明了CH2无法做FTS的链初始物种。(2)当他们通CH2N2和合成气的混气时,产物可能存在三种情况。如果是CO插入机理,那么CH2可以加氢成CH3作为链初始物种,所以产物产量会增加,但碳链分布与只通合成气时没有改变。如果是烯醇机理,产物的碳链分布会符合CH2+H2和烯醇缩合两个模型的叠加。如果是碳化物机理,CH2可以作为碳链增长的单体,所以产物中碳链的长度会变长。他们的实验发现是第三种情况,即碳化物机理。(3)当他们通同位素标记的混气(12CH2N2+13CO+H2),并检测丙烯中C的标记情况时,产物可能存在以下几种情况。如果是CO插入机理,那丙烯只可能存在两种情况13C-13C-13C或12C-13C-13C,无论哪种情况,丙烯中13C都不少于60%。因此CO插入机理对应的实验现象是无论加多少12CH2N2,丙烯中13C都不少于60%。如果是烯醇机理,那丙烯会是13C-13C-13C和12C-12C-12C的混合物。如果是碳化物机理,则各种组合都可能存在。后两种机理的区别在于在通不同比例的12CH2N2和13CO情况下,两种模型预测出的13C含量不同。最后实验发现仍然是碳化物机理。
Ritschel和Vielstich教授用HCl溶解反应后的FTS催化剂,发现溶解过程中产生的气相产物选择性与FTS反应中类似,同样证明了表面碳化物机理[3]。
Bell教授用环己烯和合成气混气作为反应物,在FTS条件下反应。产物中生成了降蒈烷(norcarane)和烷基环己烯。说明环己烯与表面生成的CH2发生了反应,间接证明了碳化物机理[4]。
(二)判定表面、界面还是顶点是活性位点
在很多催化反应中,研究人员经常认为界面是活性位点,但证明方法大多是理论计算,很难给出直接的、实验上的证据,这需要单颗粒的空间分辨率如单分子荧光显微技术[5]。2013年,Fornasiero和Murray教授通过简单得改变催化剂尺寸,通过对反应动力学的分析,证明了界面处是活性位点[6]。他们的思路很简单。表面是二维的面、界面是一维的线、顶点是零维的点。所以对于常规的多面体来说,单位体积内的表面位点数(~d2/d3)正比于d-1,单位体积内的界面位点数(~d/d3)正比于d-2,单位体积内的顶点数(~1/d3)正比于d-3。由于不同尺寸的样品形貌和晶格常数略有区别,研究人员给出了更精确的计算:单位体积内的表面位点数正比于d-0.9,单位体积内的界面位点数正比于d-1.9,单位体积内的顶点数正比于d-2.6(图1)。研究人员再把样品的转换频率(TOF)画在图上,发现TOF与d-2.3成正比,从而说明金属与载体的界面是活性位点(图1)。
图1. 模型分析[6]。
(三)氢溢流
氢溢流是各种加氢反应中常常存在的实验现象,指的是原本无法解离H2的位点吸附了H,这个位点上的H就说从能够解离H2的位点溢流过来的。Sykes教授利用这种现象设计了一个很有意思的实验[7]。他们把Pd单原子负载在Cu表面。这时候Pd能够解离H2,并且对CO具有很强的吸附能力;Cu表面无法解离H2,只能吸附解离后的H原子,并且对CO吸附能力弱。由于反应的可逆性,H2也只能在Pd表面脱附而无法在Cu表面脱附。他们先通H2,H2在Pd单原子上解离,并溢流到Cu表面;再通CO,这时候CO会吸附在Pd单原子上,将其毒化。当升温时,只有CO脱附之后,才会开始脱附H2。
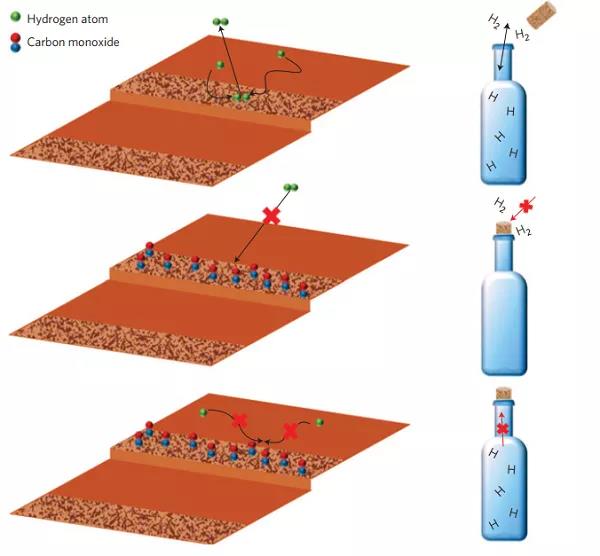
图2. 分子瓶塞效应。
科研探索本身应该是一个有趣的过程,特别是当你灵光一现,有了一个巧妙的实验构思的时候。用催化实验来探索反应机理,不仅能够弥补那些宝贵的原位机时,还能让你的研究更有艺术性。
文章转载自微信公众号:材料人